💊 Состав препарата Супракс® ✅ Применение препарата Супракс® Сохраните у себя Поиск аналогов Взаимодействие Описание активных компонентов препарата Супракс® (Suprax®) Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата. Дата обновления: 2020.06.19 Владелец регистрационного удостоверения:ASTELLAS PHARMA EUROPE, B.V. (Нидерланды) Произведено:JAZEERA PHARMACEUTICAL INDUSTRIES (Саудовская Аравия) По заказу:ASTELLAS PHARMA EUROPE, B.V. (Нидерланды) Упаковка и выпускающий контроль качества:HIKMA PHARMACEUTICALS (Иордания) Или упаковка и выпускающий контроль качества:FACTA FARMACEUTICI, S.P.A. (Италия) Код ATX: J01DD08 (Cefixime) Активное вещество: цефиксим (cefixime)Rec. Лекарственная форма
Форма выпуска, упаковка и состав препарата СупраксГранулы для приготовления суспензии для приема внутрь от почти белого до кремового цвета, мелкие; после смешивания образуется суспензия от почти белого до кремового цвета со сладким ароматом клубники.
Вспомогательные вещества: натрия бензоат — 0.03 г, сахароза — 30.225 г, камедь ксантановая — 0.155 г, ароматизатор клубничный — 0.048 г. 30.3-35.0 г — флаконы темного стекла (1) в комплекте с дозировочной ложкой объемом 10 мл или 5 мл — пачки картонные. Клинико-фармакологическая группа: Цефалоспорин III поколения Фармако-терапевтическая группа: Антибиотик-цефалоспорин Фармакологическое действиеПолусинтетический цефалоспориновый антибиотик III поколения для приема внутрь широкого спектра действия. Действует бактерицидно. Механизм действия обусловлен угнетением синтеза клеточной мембраны возбудителя. Цефиксим устойчив к действию β-лактамаз, продуцируемых большинством грамположительных и грамотрицательных бактерий. In vitro цефиксим активен в отношении грамположительных бактерий: Streptococcus agalactiae; грамотрицательных бактерий: Haemophilus parainfluenzae, Proteus vulgaris, Klebsiella pneumoniae, Klebsiella oxytoca, Pasteurella multocida, Providencia spp., Salmonella spp., Shigella spp., Citrobacter amalonaticus, Citrobacter diversus, Serratia marcescens. In vitro и в условиях клинической практики цефиксим активен в отношении грамположительных бактерий: Streptococcus pneumoniae, Streptococcus pyogenes; грамотрицательных бактерий: Haemophilus influenzae, Moraxella (Branhamella) catarrhalis, Escherichia coli, Proteus mirabilis, Neisseria gonorrhoeae. К цефиксиму устойчивы Pseudomonas spp., Enterococcus (Streptococcus) серогруппы D, Listeria monocytogenes, большинство Staphylococcus spp. (включая метицилин-резистентные штаммы), Enterobacter spp., Bacteroides fragilis, Clostridium spp. ФармакокинетикаПри приеме внутрь биодоступность цефиксима составляет 40-50% независимо от приема пищи, однако Cmax цефиксима в сыворотке достигается быстрее на 0. Показания активных веществ препарата Супракс®Инфекционно-воспалительные заболевания, вызванные чувствительными микроорганизмами: фарингит, тонзиллит, синуситы, острый и хронический бронхит, средний отит, неосложненные инфекции мочевыводящих путей, неосложненная гонорея. Открыть список кодов МКБ-10
Режим дозированияСпособ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования. Для взрослых и детей старше 12 лет с массой тела более 50 кг суточная доза составляет 400 мг (1 раз/сут или по 200 мг 2 раза/сут). Продолжительность курса лечения — 7-10 дней. При неосложненной гонорее — 400 мг однократно. Детям в возрасте до 12 лет — 8 мг/кг массы тела 1 раз/сут или по 4 мг/кг каждые 12 ч. При инфекциях, вызванных Streptococcus pyogenes, курс лечения должен составлять не менее 10 дней. При нарушениях функции почек (при КК от 21 до 60 мл/мин) или у пациентов, находящихся на гемодиализе, суточную дозу следует уменьшить на 25%. При КК≤20 мл/мин или у пациентов, находящихся на перитонеальном диализе, суточную дозу следует уменьшить в 2 раза. Побочное действиеСо стороны пищеварительной системы: сухость во рту, анорексия, диарея, тошнота, рвота, боли в животе, метеоризм, транзиторное увеличение активности печеночных трансаминаз и ЩФ, гипербилирубинемия, желтуха, кандидоз ЖКТ, дисбактериоз; редко — стоматит, глоссит, псевдомембранозный энтероколит. Со стороны системы кроветворения: лейкопения, тромбоцитопения, нейтропения, гемолитическая анемия. Со стороны ЦНС: головокружение, головная боль. Со стороны мочевыделительной системы: интерстициальный нефрит. Аллергические реакции: кожный зуд, крапивница, гиперемия кожи, эозинофилия, лихорадка. Противопоказания к применениюПовышенная чувствительность к цефалоспоринам и пенициллинам. Применение при беременности и кормлении грудьюПрименение при беременности возможно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода. При необходимости применения в период лактации следует прекратить грудное вскармливание. Применение при нарушениях функции почекПри нарушениях функции почек (при КК от 21 до 60 мл/мин) или у пациентов, находящихся на гемодиализе, суточную дозу следует уменьшить на 25%. При КК≤20 мл/мин суточную дозу следует уменьшить в 2 раза. Применение у детейС осторожностью следует применять у детей в возрасте до 6 мес. Применение у пожилых пациентовС осторожностью следует применять у пациентов пожилого возраста. Особые указанияС осторожностью следует применять у пациентов пожилого возраста, пациентов с хронической почечной недостаточностью или псевдомембранозным колитом (в анамнезе), у детей в возрасте до 6 мес. При длительном применении возможно нарушение нормальной микрофлоры кишечника, что может привести к росту Clostridium difficile и вызвать развитие тяжелой диареи и псевдомембранозного колита. У пациентов с указанием в анамнезе аллергические реакции на пенициллины, возможны проявления повышенной чувствительности к цефалоспориновым антибиотикам. Во время лечения возможна положительная прямая реакция Кумбса и ложноположительная реакция мочи на глюкозу. Сохраните у себя | ||||||||||||||||||||||||||||||||||||||||||||||||||||
инструкция по применению, классификация, статьи » Справочник ЛС
Абсорбция:
Согласно результатам исследований с участием здоровых добровольцев, после перорального приёма цефиксима максимальные концентрации в сыворотке достигаются, как правило, через 3-4 часа. После приёма однократной дозы 50, 100 и 200 мг средние максимальные концентрации в сыворотке составили 1,02, 1,46 и 2,63 мг/л, соответственно, у 12 здоровых представителей белой европеоидной расы, и 0,69, 1,13 и 1,95 мг/л, соответственно, у 12 здоровых японцев.
Детская популяция:
После приёма однократной дозы 1,5, 3,0 и 6,0 мг/кг цефиксима японскими пациентами детского возраста максимальные концентрации в сыворотке через 3-4 часа составили 1,14, 2,01 и 3,97 мг/л, соответственно.
Распределение:
В плазме крови человека цефиксим связывается с белками приблизительно на 70%, при этом уровень связывания не зависит от концентрации в диапазоне 0,5-30 мг/л. Цефиксим распределяется, достигая концентраций в органах/тканях и биологических жидкостях, таких, как слюна, миндалины, слизистая оболочка верхнечелюстных пазух, отделяемое среднего уха, желчь, тканях легких и желчного пузыря.
Метаболизм и выведение:
Биологически активные метаболиты цефиксима не были обнаружены в плазме или моче здоровых добровольцев после перорального приёма препарата. Приблизительно 20% от 200 мг дозы цефиксима у здоровых добровольцев выводится почками в неизменённом виде. Период полувыведения составляет 2-4 часа.
Почечная недостаточность:
В исследованиях с участием пациентов с различной степенью тяжести нарушения функции почек изучали фармакокинетику однократной пероральной дозы 400 мг. Согласно результатам исследований, период полувыведения, общий клиренс (CL/F), почечный клиренс и величина площади под фармакокинетической кривой (AUC) y пациентов с тяжёлой почечной недостаточностью (клиренс креатинина < 20 мл/мин), пациентов на гемодиализе или на постоянном амбулаторном перитонеальном диализе (CAPD) отличались от соответствующих показателей здоровых добровольцев.
Согласно результатам исследований, период полувыведения, общий клиренс (CL/F), почечный клиренс и величина площади под фармакокинетической кривой (AUC) y пациентов с тяжёлой почечной недостаточностью (клиренс креатинина < 20 мл/мин), пациентов на гемодиализе или на постоянном амбулаторном перитонеальном диализе (CAPD) отличались от соответствующих показателей здоровых добровольцев.
Фармакокинетические характеристики (средние значения) цефиксима у здоровых добровольцев и пациентов
с различной степенью тяжести почечной дисфункции
| Исследуемая группа | CLCr (мл/мин/1,73 м2) | Cmax (мг/л) | Тmах (ч) | Т1/2β (ч) | AUC (мгхч/л) | CL/F (мл/кг/ч) | Почечный клиренс (мл/кг/ч) |
| Здоровые добровольцы | 111 | 4,9 | 4,9 | 3,2 | 40 | 141 | 22 |
| Степень тяжести почечной дисфункции | |||||||
| Очень легкая | 71 | 5,8 | 4,0 | 4,7 | 57 | 127 | 22 |
| Легкая | 51 | 7,6 | 4,5 | 7,0 | 90 | 70 | 10 |
| Умеренная | 28 | 7,5 | 3,5 | 7,2 | 100 | 80 | 3,7 |
| Тяжелая | 9,8 | 9,6 | 6,0 | 11,5* | 188* | 41* | 2,1* |
| Гемодиализ | 1,3 | 6,2 | 4,8 | 8,2 | 94 | 73 | 0,4* |
| CAPD | 3,0 | 10,2 | 5,0 | 14,9* | 220* | 42* | 0,5* |
Расхождение, статистически значимое по сравнению с показателями здоровых добровольцев.
Сокращения: CLCr — клиренс креатинина, Сmах — максимальная концентрация, Тmах — время достижения максимальной концентрации, Т1/2β — период полувыведения, CL/F — общий клиренс, CAPD — постоянный амбулаторный перитонеальный диализ, AUC — площадь под фармакокинетической кривой.
* р < 0,05 по сравнению со здоровыми добровольцами.
Детям в возрасте от 6 месяцев до 12 лет назначают в виде суспензии в дозе 8 мг/кг/сутки однократно или в 2 приема по 4 мг/кг каждые 12 ч. Необходимо всегда строго придерживаться дозировки, назначенной врачом. При наличии сомнений в правильности применения следует проконсультироваться с лечащим врачом.
В случае, если упаковка комплектуется дозировочным шприцом, необходимо руководствоваться следующей таблицей подбора доз:
Подбор дозы суспензии для приема внутрь, 100 мг/5 мл, с помощью дозировочного шприца
| Масса тела, кг | Суточная доза, мг | Доза суспензии, мл (прием 1 раз в сутки) | Доза суспензии, мл (прием 2 раза в сутки) |
| 6 | 46 | 2,4 | 1,2 |
| 7 | 56 | 2,8 | 1,4 |
| 8 | 64 | 3,2 | 1,6 |
| 9 | 72 | 3,6 | 1,8 |
| 10 | 80 | 4 | 2 |
| 11 | 88 | 4,4 | 2,2 |
| 12 | 96 | 4,8 | 2,4 |
| 13 | 104 | 5,2 | 2,6 |
| 4,8 мл + 0,4 мл | |||
| 14 | 112 | 5,6 | 2,8 |
| 1 полный шприц + 0,6 мл | |||
| 15 | 120 | 6 | 3 |
| 1 полный шприц + 1 мл | |||
| 16 | 128 | 6,4 | 3,2 |
| 1 полный шприц + 1,4 мл | |||
| 17 | 136 | 6,8 | 3,4 |
| 1 полный шприц + 1,8 мл | |||
| 18 | 144 | 7,2 | 3,6 |
| 1 полный шприц + 2,2 мл | |||
| 19 | 152 | 7,6 | 3,8 |
| 1 полный шприц + 2,6 мл | |||
| 20 | 160 | 8 | 4 |
| 1 полный шприц + 3 мл | |||
| 21 | 168 | 8,4 | 4,2 |
| 1 полный шприц + 3,4 мл | |||
| 22 | 176 | 8,8 | 4,4 |
| 1 полный шприц + 3,8 мл | |||
| 23 | 184 | 9,2 | 4,6 |
| 1 полный шприц + 4,2 мл | |||
| 24 | 192 | 9,6 | 4,8 |
| 1 полный шприц + 4,6 мл | |||
| 25 | 200 | 10 | 5 |
| 2 полных шприца | |||
| 26 | 208 | 10,4 | 5,2 |
| 2 полных шприца + 0,4 мл | 4,8 + 0,4 мл | ||
| 27 | 216 | 10,8 | 5,4 |
| 2 полных шприца + 0,8 мл | 1 полный шприц + 0,4 мл | ||
| 28 | 224 | 11,2 | 5,6 |
| 2 полных шприца + 1,2 мл | 1 полный шприц + 0,6 мл | ||
| 29 | 232 | 11,6 | 5,8 |
| 2 полных шприца + 1,6 мл | 1 полный шприц + 0,8 мл | ||
| 30 | 240 | 12 | 6 |
| 2 полных шприца + 2 мл | 1 полный шприц + 1 мл | ||
| 31 | 248 | 12,4 | 6,2 |
| 2 полных шприца + 2,4 мл | 1 полный шприц + 1,2 мл | ||
| 32 | 256 | 12,8 | 6,4 |
| 2 полных шприца + 2,8 мл | 1 полный шприц + 1,4 мл | ||
| 33 | 264 | 13,2 | 6,6 |
| 2 полных шприца + 3,2 мл | 1 полный шприц + 1,6 мл | ||
| 34 | 272 | 13,6 | 6,8 |
| 2 полных шприца + 3,6 мл | 1 полный шприц + 1,8 мл | ||
| 35 | 280 | 14 | 7 |
| 2 полных шприца + 4 мл | 1 полный шприц + 2 мл | ||
| 36 | 288 | 14,4 | 7,2 |
| 2 полных шприца + 4,4 мл | 1 полный шприц + 2,2 мл | ||
| 37 | 296 | 14,8 | 7,4 |
| 2 полных шприца + 4,8 мл | 1 полный шприц + 2,4 мл | ||
| 38 | 304 | 15,2 | 7,6 |
| 2 полных шприца + 4,8 + 0,4 мл | 1 полный шприц + 2,6 мл | ||
| 39 | 312 | 15,6 | 7,8 |
| 3 полных шприца + 0,6 мл | 1 полный шприц + 2,8 мл | ||
| 40 | 320 | 16 | 8 |
| 3 полных шприца + 1 мл | 1 полный шприц + 3 мл | ||
| 41 | 328 | 16,4 | 8,2 |
| 3 полных шприца + 1,4 мл | 1 полный шприц + 3,2 мл | ||
| 42 | 336 | 16,8 | 8,4 |
| 3 полных шприца + 1,8 мл | 1 полный шприц + 3,4 мл | ||
| 43 | 344 | 17,2 | 8,6 |
| 3 полных шприца + 2,2 мл | 1 полный шприц + 3,6 мл | ||
| 44 | 352 | 17,6 | 8,8 |
| 3 полных шприца + 2,6 мл | 1 полный шприц + 3,8 мл | ||
| 45 | 360 | 18 | 9 |
| 3 полных шприца + 3 мл | 1 полный шприц + 4 мл | ||
| 46 | 368 | 18,4 | 9,2 |
| 3 полных шприца + 3,4 мл | 1 полный шприц + 4,2 мл | ||
| 47 | 376 | 18,8 | 9,4 |
| 3 полных шприца + 3,8 мл | 1 полный шприц + 4,4 мл | ||
| 48 | 384 | 19,2 | 9,6 |
| 3 полных шприца + 4,2 мл | 1 полный шприц + 4,6 мл | ||
| 49 | 392 | 19,6 | 9,8 |
| 3 полных шприца + 4,6 мл | 1 полный шприц + 4,8 мл | ||
| 50 | 400 | 20 | 10 |
| 4 полных шприца | 2 полных шприца |
B случае, если упаковка комплектуется дозировочной ложкой, необходимо руководствоваться следующей таблицей подбора доз:
Подбор дозы суспензии для приема внутрь 100 мг/5 мл, с помощью дозировочной ложки
| Масса тела, кг | Доза суспензии, мл (прием 1 раз в сутки) | Доза суспензии, мл (прием 2 раз в сутки) |
| До 6 кг | 2,5 мл | 1,25 мл |
| 6-12,5 кг | 5 мл | 2,5 мл |
| 12,5-25 кг | 10 мл | 5 мл |
| 25-37,5 кг | 15 мл | 7,5 мл |
| более 37,5 кг | 20 мл | 10 мл |
Для взрослых и детей старше 12 лет с массой тела более 50 кг — 400 мг 1 раз в сутки или по 200 мг 2 раза в сутки.
Средняя продолжительность курса лечения — 7-10 дней.
При заболеваниях, вызванных Streptococcus pyrogenes, курс лечения — не менее 10 дней.
При нарушении функции почек дозу устанавливают в зависимости от показателя клиренса креатинина (КК): при КК 21-60 мл/мин или у пациентов, находящихся на гемодиализе, суточную дозу следует уменьшить на 25%. При КК 20 мл/мин у пациентов, находящихся на перитонеальном диализе, суточную дозу следует уменьшить вдвое.
Будьте внимательны! Дозировочный шприц или дозировочная ложка используются исключительно для перорального введения суспензии Супракс и не должны применяться для дозирования другого лекарственного средства.
Не используйте другие приспособления для дозирования и введения препарата Супракс (шприц, ложку, пипетку от другого препарата), помимо специального шприца или ложки, поставляемых в комплекте.
Способ приготовления суспензии: перевернуть флакон и встряхнуть содержимое флакона. Добавить 40 мл (суммарный объем) охлажденной кипяченой воды в 2 этапа или довести объем суспензии до риски (метка в виде стрелки на этикетке флакона, при наличии этой метки). Взболтать суспензию до образования гомогенной суспензии, дать ей отстояться в течение 5 минут для обеспечения полного растворения порошка. Если на флаконе есть метка в виде стрелки, убедитесь (после осаждения пены), чтобы объем достиг метки. Если этого не произошло, доведите объем до метки еще раз.
Взболтать суспензию до образования гомогенной суспензии, дать ей отстояться в течение 5 минут для обеспечения полного растворения порошка. Если на флаконе есть метка в виде стрелки, убедитесь (после осаждения пены), чтобы объем достиг метки. Если этого не произошло, доведите объем до метки еще раз.
Перед применением готовую суспензию необходимо хорошо взбалтывать.
Использовать суспензию в течение 14 дней с момента приготовления при соблюдении условий хранения (от 15 до 25 °С). Не замораживать!
Нарушения со стороны крови и лимфатической системы: эозинофилия, гранулоцитопения, гемолитическая анемия, тромбоцитопения, панцитопения, лейкопения, нейтропения, агранулоцитоз, апластическая анемия, кровотечения.
Нарушения со стороны желудочно-кишечного тракта: боль в животе, диарея, диспепсия, тошнота, рвота, сухость во рту, анорексия, запор, метеоризм, дисбактериоз, стоматит, глоссит.
Нарушения со стороны печени и желчевыводящих путей: желтуха, нарушение функции печени, холестаз, гепатит.
Инфекционные и паразитарные заболевания: псевдомембранозный колит, кандидоз.
Нарушения со стороны иммунной системы: анафилактическая реакция, сывороточная болезнь, анафилактический шок.
Изменения лабораторных показателей: увеличение уровня аспартатаминотрансферазы, увеличение уровня аланинаминотрансферазы, увеличение уровня щелочной фосфатазы крови, увеличение уровня билирубина крови, увеличение уровня мочевины крови, увеличение уровня креатинина крови, увеличение протромбинового времени.
Нарушения со стороны нервной системы: головокружение, головная боль, шум в ушах, судороги, гиперчувствительность.
Нарушения со стороны кожи и подкожной клетчатки: лекарственная сыпь с эозинофилией и системной симптоматикой (DRESS-синдром), зуд, сыпь, мультиформная экссудативная эритема (в т.ч. синдром Стивенса-Джонсона), токсический эпидермальный некролиз (синдром Лайелла), крапивница, ангионевротический отек, полиморфная эритема.
Со стороны мочевыделительной системы: интерстициальный нефрит, нарушение функции почек, острая почечная недостаточность.
Со стороны половой системы: вагинит, зуд половых органов.
Прочие: лихорадка, отек лица, одышка, развитие гиповитаминоза В.
Как восстановить пероральные суспензии за 7 шагов
Порошки для пероральной суспензии представляют собой препараты, состоящие из твердых, рыхлых, сухих частиц разной степени мелкого размера. Они разработаны в виде порошковых смесей типичных ингредиентов, необходимых для водной суспензии. Как указывалось ранее в статье «жидкие лекарственные формы: фармацевтические суспензии», эти официальные препараты имеют в своем официальном названии «для пероральной суспензии», чтобы отличить их от готовых суспензий (то есть суспензий, которые доступны в готовой к употреблению форме от производитель).
Порошки для приготовления суспензий продаются как пероральные восстанавливаемые лекарственные средства в одноразовых пакетиках или во флаконах с несколькими дозами. Большинство препаратов, приготовленных в виде сухой смеси для пероральной суспензии, являются антибиотиками. Они могут содержать эксципиенты, в частности, для облегчения диспергирования или растворения и предотвращения слеживания.
Большинство препаратов, приготовленных в виде сухой смеси для пероральной суспензии, являются антибиотиками. Они могут содержать эксципиенты, в частности, для облегчения диспергирования или растворения и предотвращения слеживания.
Популярность этой лекарственной формы обусловлена присущей суспензиям физической нестабильностью и желательностью относительно длительного срока хранения.
Содержимое
- 1 Типы порошка для приготовления суспензии для приема внутрь
- 1.1 а. Стандартная доза / разовая доза порошков для пероральной суспензии
- 1.2 b. Многодозовые порошки для приготовления суспензии для приема внутрь
- 2 Идеальные свойства порошка для приготовления суспензии
- 3 Как разводить суспензию для приема внутрь
- 4 Примеры антибиотиков для приготовления суспензии для приема внутрь
- 5 Справочная информация
8 Типы порошка для приготовления суспензии для приема внутрь
8 . Стандартная доза / разовая доза порошков для пероральной суспензии
Пакетик с разовой дозой порошка можно вводить пациенту, посыпая сверху полутвердую пищу, такую как желе или мороженое, или путем суспендирования в подходящем носителе, таком как вода или сок, непосредственно перед введением. Этот способ введения предпочтителен для детей и пожилых людей, у которых могут возникнуть трудности с глотанием, а также для соединений с высокими дозами.
Этот способ введения предпочтителен для детей и пожилых людей, у которых могут возникнуть трудности с глотанием, а также для соединений с высокими дозами.
Ключевым требованием к этой лекарственной форме является вкусовая привлекательность препарата. Чрезвычайно горькие или неприятные на вкус лекарственные средства, как правило, не подходят для изготовления в виде порошка для приготовления суспензии.
б. Многодозовые порошки для пероральной суспензии
Многодозовые порошки для пероральной суспензии выдаются в виде порошка во флаконе подходящего размера для разведения водой фармацевтом непосредственно перед выдачей. Превосходная стабильность порошкообразной лекарственной формы обеспечивает длительный срок хранения коммерческого продукта при комнатной температуре препарата, который очень нестабилен в присутствии воды.
Восстановленная суспензия имеет ограниченный срок годности при определенных условиях хранения, например, 14 дней в холодильнике.
Идеальные свойства порошка для приготовления суспензии
Качественные характеристики суспензии, восстановленной из порошка для приготовления суспензии, такие же, как и у суспензии, которая продается в готовой к употреблению форме. Кроме того, существуют требования к качеству единичной дозы порошка для суспензионных пакетиков или многодозового порошка для суспензионного порошка во флаконе. К ним относятся
Кроме того, существуют требования к качеству единичной дозы порошка для суспензионных пакетиков или многодозового порошка для суспензионного порошка во флаконе. К ним относятся
- Объем заполнения : Количество порошка в контейнере должно строго контролироваться, чтобы оно было как можно ближе к количеству, указанному на этикетке. Для контейнера с единичной дозой измеряется дозируемое или доставляемое количество в дополнение к количеству, указанному на этикетке.
- Время восстановления : Поскольку порошки для приготовления суспензии предназначены для приготовления пациентом или фармацевтом, суспензия должна быть легко приготовлена при добавлении воды и разумном ручном перемешивании.
- Однородность содержимого : Однородность содержимого порошка для суспензии от контейнера к контейнеру важна для обеспечения однородности количества лекарственного средства, распределяемого по различным контейнерам.

- Физическая и химическая стабильность : Порошок для приготовления суспензии должен сохранять физическую и химическую стабильность в течение всего указанного на этикетке срока годности при указанных на этикетке условиях хранения.
Как разводить суспензии для приема внутрь
Этапы восстановления суспензий для приема внутрь:
Шаг 1: Определите тип и объем необходимого разбавителя
Шаг 2: Осторожно встряхните флакон, чтобы растворить порошок. Откройте крышку бутылки.
Шаг 3: Для флаконов с антибиотиками с маркировкой осторожно налейте прохладную кипяченую воду примерно до половины высоты окончательной маркировки на флаконе. Что касается бутылок с антибиотиками без маркировки, пожалуйста, обратитесь к упаковке антибиотика, информационным листкам для пациентов, предоставленным производителем, или к вашему фармацевту для получения информации о необходимом объеме воды для смешивания сухого порошка антибиотика. Вы можете использовать маркированный мерный стакан, чтобы отмерить необходимое количество воды.
Вы можете использовать маркированный мерный стакан, чтобы отмерить необходимое количество воды.
Шаг 4: Установите на бутыль крышку. Встряхивайте флакон до тех пор, пока весь порошок не будет тщательно перемешан.
Шаг 5: Оставьте суспензию на 2-5 минут, чтобы удалить пузырьки воздуха из бутыли.
Шаг 6: Откройте крышку. Аккуратно добавьте воду до последней маркировки на бутылке.
Шаг 7: Установите на бутыль крышку. Переверните бутылку и энергично встряхните бутылку в течение не менее 5 секунд, чтобы получить однородную суспензию. Перед введением пациенту убедитесь, что лекарство полностью растворилось.
Применение пероральной суспензии
Шаг 8: Хорошо встряхните приготовленную суспензию перед введением каждой дозы. Чтобы убедиться, что вы даете правильную дозу, используйте измерительный инструмент, который поставляется с лекарством, например, оральный шприц, мерная ложка или калиброванная чашка для лекарств. Если лекарство не поставляется с мерным инструментом, вы можете попросить своего фармацевта порекомендовать его.
Если лекарство не поставляется с мерным инструментом, вы можете попросить своего фармацевта порекомендовать его.
Не используйте кухонную чайную или столовую ложку, поскольку они не точны.
Хранение восстановленного порошка для приготовления суспензии для приема внутрь
Этап 9: Суспензию следует хранить в холодильнике или хранить при комнатной температуре в сухом прохладном месте при температуре ниже 25 – 30 o C, если не указано иное. Не замораживайте препарат.
Шаг 10: Утилизируйте оставшуюся суспензию по истечении срока годности в соответствии с рекомендациями после восстановления.
Примечание: Если у вас есть более одного флакона одной и той же суспензии, закончите один флакон, прежде чем смешивать второй.
Примеры антибиотиков для пероральной суспензии
- Цефуроксим аксетил для пероральной суспензии, USP (Цероксим для пероральной суспензии, Sun Pharmaceutical)
- Цефалексин для пероральной суспензии, USP (Ascend Laboratories)
- Флуконазол для пероральной суспензии, USP (Aurobindo)
- Доксициклин для пероральной суспензии, USP (вибрамицина моногидрат для пероральной суспензии, Pfizer)
- Cefpodoxime Proxetil for Oral Suspension, USP (Rising Cefpodoxime Proxetil for Oral Suspension, Rising Pharmaceuticals, Inc.
 )
) - Цефиксим для пероральной суспензии, USP (супракс, порошок для пероральной суспензии, Люпин Фарма)
- Азитромицин для пероральной суспензии, USP (Teva Pharmaceutical Industries Ltd.)
- Амоксициллин для пероральной суспензии, USP (Амоксил для пероральной суспензии, GlaxoSmithKline)
Ссылка
- Аллен, Л. и Ансель, Х. (2014). Фармацевтические лекарственные формы и системы доставки лекарств Ansel (10 th ed.). Филадельфия, Липпинкотт Уильямс и Уилкинс.
- https://www.austincc.edu/rxsucces/pdf/reconstructionpdf.pdf
- Махато Р. и Наранг А. (2018). Фармацевтические лекарственные формы и доставка лекарств (3 rd ed.). Нью-Йорк: Taylor & Francis Group, LLC.
Ключевое слово, связанное с тем, как разводить пероральные суспензии: восстановленные суспензии антибиотиков, сухая суспензия для разведения, как разводить пероральные суспензии, вода для разведения антибиотиков, истечение срока действия восстановленных антибиотиков, хранение суспензии антибиотиков, порошок амоксициллина для суспензии, как смешивать порошкообразный пенициллин, как разводить порошок антибиотика, смешивать порошкообразные лекарства с суспензиями, как восстанавливать пероральные суспензии, как использовать пероральную суспензию цефалексина внутрибрюшинно для младенцев, восстановленные суспензии антибиотиков, сухую суспензию для восстановления, как смешивать суспензию? Как смешивать суспензию антибиотика? Как восстановить лекарство? Нужно ли добавлять воду в амоксициллин?
Патент США на фармацевтические композиции цефиксима Патент (Патент № 9,241,905, выдан 26 января 2016 г.
 ) 330/KOL/2006, поданной 13 апреля 2006 г. в Индии, и эта заявка (заявки) включена в настоящее описание посредством ссылки. В той мере, в какой это уместно, притязание на приоритет делается в отношении каждой из раскрытых выше заявок.
) 330/KOL/2006, поданной 13 апреля 2006 г. в Индии, и эта заявка (заявки) включена в настоящее описание посредством ссылки. В той мере, в какой это уместно, притязание на приоритет делается в отношении каждой из раскрытых выше заявок.ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической суспензии, содержащей цефиксим новой концентрации 200 мг/5 мл.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Цефиксим представляет собой полусинтетический цефалоспориновый антибиотик для перорального введения. Впервые он был раскрыт в патенте США No. № 4409214 от Fujisawa Corporation, Япония.
Обладает бактерицидным действием, механизм действия основан на ингибировании синтеза клеточной стенки бактерий.
Показан для лечения инфекций, вызванных различными грамположительными и грамотрицательными микроорганизмами, в основном неосложненных инфекций мочевыводящих путей, вызванных E. coli и P. mirabilis , среднего отита, вызванного H. influenza, M. catarrhalis и S. pyogenes , острый бронхит и обострения хронического бронхита, вызванные S. pneumonia и H. influenza . Он также показан при неосложненной гонорее, вызванной Н. гонорея . Это один из наиболее часто назначаемых препаратов в педиатрии.
coli и P. mirabilis , среднего отита, вызванного H. influenza, M. catarrhalis и S. pyogenes , острый бронхит и обострения хронического бронхита, вызванные S. pneumonia и H. influenza . Он также показан при неосложненной гонорее, вызванной Н. гонорея . Это один из наиболее часто назначаемых препаратов в педиатрии.
Цефиксим в качестве лекарственного средства плохо растворим в воде. С точки зрения биодоступности предпочтительной формой введения труднорастворимых лекарственных средств, таких как бета-лактамные антибиотики, часто является водная суспензия. Цефиксим, принимаемый перорально, всасывается примерно на 40-50% вне зависимости от приема пищи.
Дети в возрасте 12 лет и младше получают, например, около 8 мг цефиксима/кг массы тела каждый день. Рекомендуемую дозу можно вводить попеременно сразу или разделить на 2 приема (например, около 4 мг цефиксима/кг массы тела утром и вечером). В зависимости от тяжести и локализации инфекции возможно увеличение суточной дозы до 2,6 мг цефиксима/кг массы тела. Взрослые и дети старше 12 лет могут принимать по 400 мг цефиксима в сутки. Рекомендуемую суточную дозу можно вводить попеременно целиком или разделить на 2 приема (утром и вечером). Дозу следует уменьшить у пациентов с выраженным нарушением функции почек.
Взрослые и дети старше 12 лет могут принимать по 400 мг цефиксима в сутки. Рекомендуемую суточную дозу можно вводить попеременно целиком или разделить на 2 приема (утром и вечером). Дозу следует уменьшить у пациентов с выраженным нарушением функции почек.
Твердые лекарственные формы, такие как таблетки и капсулы, имеют определенные недостатки, поскольку они должны распадаться в желудочно-кишечном тракте, а затем лекарство должно раствориться, прежде чем оно сможет всосаться, что приводит к более медленному всасыванию по сравнению с суспензией лекарственной формы и также абсорбция меньше, чем у суспензионной лекарственной формы, что приводит к проблемам биоэквивалентности. Кроме того, некоторые группы пациентов, такие как педиатры и гериатры, испытывают трудности при глотании таблеток и капсул, и существует практическое ограничение размера и, следовательно, дозы, которую можно проглотить.
Лекарственные формы в виде суспензии для перорального применения имеют определенные преимущества по сравнению с вышеупомянутыми лекарственными формами, особенно в таких группах населения, как педиатрия и гериатрия, у которых есть проблемы с проглатыванием твердых лекарственных форм. Кроме того, лекарственная форма в виде суспензии для перорального применения дает средние пиковые концентрации примерно на 25-50% выше, чем в обычных таблетках. Площадь под кривой время-концентрация примерно на 10-25% больше при приеме пероральной суспензии, чем при приеме обычных таблеток после доз от 100 до 400 мг при тестировании на нормальных взрослых добровольцах.
Кроме того, лекарственная форма в виде суспензии для перорального применения дает средние пиковые концентрации примерно на 25-50% выше, чем в обычных таблетках. Площадь под кривой время-концентрация примерно на 10-25% больше при приеме пероральной суспензии, чем при приеме обычных таблеток после доз от 100 до 400 мг при тестировании на нормальных взрослых добровольцах.
Патент США. US 4079138 от American Home Products Corporation описывает постоянную суспензию на неводной основе в качестве носителя для активных веществ, чувствительных к гидролизу.
Патент США. В US 5776926 Merck описаны композиции цефиксима в форме неводных суспензий.
Цефиксим в настоящее время доступен в различных формах с различной дозировкой для взрослых и детей, например, в виде таблеток, содержащих 200 мг и 400 мг цефиксима, и в виде пероральной суспензии, содержащей 100 мг/5 мл цефиксима.
У некоторых пациентов комплаентность доступной в настоящее время пероральной суспензии низкая из-за необходимости дозирования более 100 мг при определенных болезненных состояниях. Отсутствие лекарственной формы в виде суспензии для перорального применения, содержащей более 100 мг/5 мл цефиксима, приводит к низким показателям соблюдения режима лечения. Это связано с тем, что требуется многократное дозирование, что приводит к низким показателям соблюдения (например, утечка).
Отсутствие лекарственной формы в виде суспензии для перорального применения, содержащей более 100 мг/5 мл цефиксима, приводит к низким показателям соблюдения режима лечения. Это связано с тем, что требуется многократное дозирование, что приводит к низким показателям соблюдения (например, утечка).
Существует потребность в разработке пероральной суспензии с более высокой концентрацией в стандартной дозе для улучшения соблюдения пациентом режима лечения и снижения частоты дозирования.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Целью изобретения является разработка суспензионной лекарственной формы, содержащей стандартную дозу более 100 мг/5 мл и не более 400 мг/5 мл цефиксима и фармацевтически приемлемых наполнителей.
Основной целью изобретения является разработка суспензионной лекарственной формы, состоящей по существу из стандартной дозы 200 мг/5 мл цефиксима и фармацевтически приемлемых наполнителей.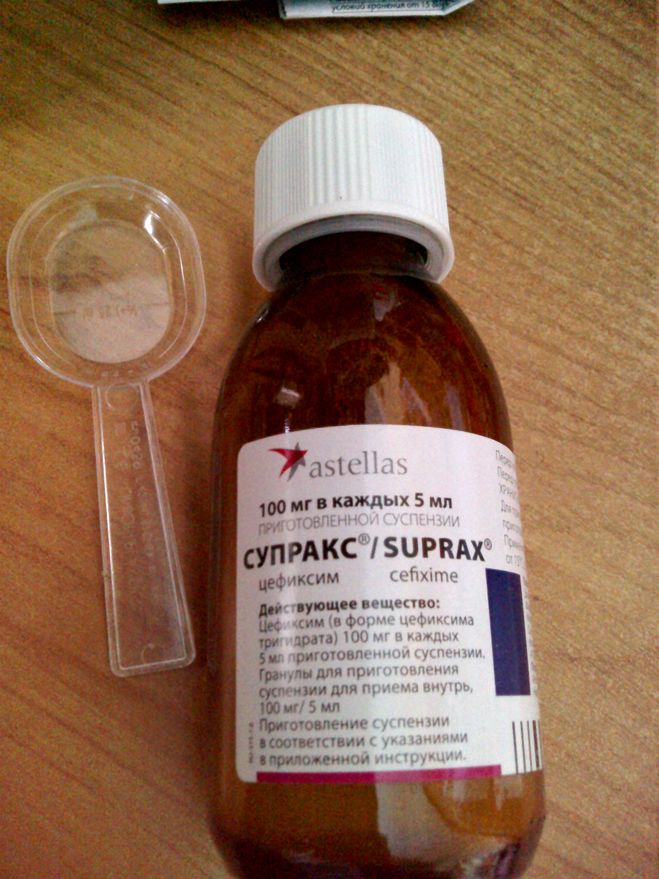
Другой целью изобретения является создание лекарственной формы в виде суспензии, содержащей цефиксим, где указанная новая концентрация суспензии 200 мг/5 мл является биоэквивалентной суспензии 2×100 мг/5 мл, содержащей тригидрат цефиксима, продаваемой под названием «Suprax®». ».
Другой целью настоящего изобретения является создание способа лечения острого бактериального среднего отита, фарингита, тонзиллита, острого и хронического бронхита пероральной суспензией цефиксима, где указанная форма суспензии состоит в основном из стандартной дозы 200 мг/5 мл. цефиксима и фармацевтически приемлемых вспомогательных веществ.
Еще одной целью изобретения является создание способа лечения неосложненных инфекций мочевыводящих путей и гонореи с помощью пероральной суспензии цефиксима, где указанная форма суспензии состоит по существу из стандартной дозы 200 мг/5 мл цефиксима и фармацевтически приемлемых наполнителей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает пероральную суспензию, содержащую стандартную дозу более 100 мг/5 мл и не более 400 мг/5 мл цефиксима.
В предпочтительном варианте осуществления настоящее изобретение обеспечивает пероральную фармацевтическую суспензионную композицию, содержащую цефиксим 200 мг/5 мл. В другом варианте осуществления настоящее изобретение относится к пероральной фармацевтической суспензионной композиции, содержащей цефиксим 200 мг/5 мл, которая является биоэквивалентной суспензионной лекарственной форме цефиксима 2×100 мг/5 мл, продаваемой под торговым наименованием SUPRAX®.
Используемый здесь термин цефиксим также обозначает различные солевые формы цефиксима, включая обычно используемую форму тригидратной соли.
Термин «суспензия для приема внутрь» включает в себя, но не ограничивается этим, композиции, выбранные из группы, состоящей из гранул для приготовления суспензии, которые могут быть покрыты или непокрыты, гранул для приготовления суспензии в форме пакета стандартной дозы (иногда называемого в данной области техники как «саше»), в виде суспензии, приготовленной из пакета стандартной дозы, в форме порошка для приготовления суспензии для приема внутрь, в форме устройства для высасывания дозы и в форме суспензии для приема внутрь на se (жидкая суспензия) и их комбинации, например. гранулы с покрытием, наполненные дозирующим устройством или саше. Отмечено, что при составлении пакета стандартной дозы он, вероятно, в основном находится в форме суспензии, если восстанавливается в соответствии с указаниями, хотя степень суспензии по сравнению с раствором зависит от ряда факторов, таких как рН.
гранулы с покрытием, наполненные дозирующим устройством или саше. Отмечено, что при составлении пакета стандартной дозы он, вероятно, в основном находится в форме суспензии, если восстанавливается в соответствии с указаниями, хотя степень суспензии по сравнению с раствором зависит от ряда факторов, таких как рН.
Предпочтительные пероральные фармацевтические суспензионные композиции, содержащие цефиксим, имеют форму порошка для приготовления суспензии.
Композиция фармацевтической суспензии для перорального применения может дополнительно содержать по меньшей мере один эксципиент в зависимости от лекарственной формы, например будь то гранулы или гранулы для суспензии и так далее. Эксципиент может быть одним или несколькими, выбранными из группы, состоящей из разбавителей, подсластителей, агентов, повышающих вязкость, диспергирующих агентов, консервантов, ароматизаторов и т.п. Один эксципиент может выполнять более одной функции.
Разбавители включают, но не ограничиваются ими, сахарозу, сорбит, ксилит, декстрозу, фруктозу, малитол, сахар калия, аспартам, сахарин, сахарин натрия и их смеси. Предпочтительным разбавителем по настоящему изобретению является сахароза. Разбавители также можно использовать в качестве подсластителя.
Предпочтительным разбавителем по настоящему изобретению является сахароза. Разбавители также можно использовать в качестве подсластителя.
Подходящие подсластители включают, но не ограничиваются ими, натуральные подсластители, такие как сахара, т.е. фруктоза, глюкоза, сахароза, сахарные спирты, такие как маннит, сорбит или их смеси, и искусственные подсластители, такие как сахарин натрия, цикламат натрия и аспартам.
Термин «усилитель вязкости», используемый в данном документе, относится к агенту или смеси агентов, которые увеличивают густоту жидкости, тем самым удерживая активный ингредиент во взвешенном состоянии для обеспечения точной дозировки. Усилители вязкости включают, но не ограничиваются ими, ксантановую камедь, гуаровую камедь, аравийскую камедь, альгиновую кислоту, альгинат натрия, альгинат пропиленгликоля, повидон, карбомер, соли карбоксиметилцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, бентонит. , полидекстроза, каррагинан, сахароза, сорбит, ксилит, декстроза, фруктоза, малитол, желатин, трагакант, поливиниловый спирт, цетеариловый спирт, коллоидный диоксид кремния и их смеси. Предпочтительным усилителем вязкости по настоящему изобретению является ксантановая камедь.
, полидекстроза, каррагинан, сахароза, сорбит, ксилит, декстроза, фруктоза, малитол, желатин, трагакант, поливиниловый спирт, цетеариловый спирт, коллоидный диоксид кремния и их смеси. Предпочтительным усилителем вязкости по настоящему изобретению является ксантановая камедь.
Диспергирующие агенты включают, но не ограничиваются ими, коллоидный диоксид кремния и поверхностно-активные вещества, где поверхностно-активное вещество используется отдельно или в смеси с одним или несколькими поверхностно-активными веществами. Также можно использовать комбинации коллоидного диоксида кремния с одним или несколькими поверхностно-активными веществами.
Термин «ароматизатор», используемый в настоящем документе, относится к агенту или смеси агентов, которые придают смеси аромат. Ароматизаторы включают, но не ограничиваются ими, искусственный клубничный ароматизатор, искусственный банановый ароматизатор и искусственный сливочный ароматизатор. Предпочтительным ароматизирующим агентом по настоящему изобретению является клубничный ароматизатор.
Термин «консервант», используемый в настоящем документе, относится к агенту или смеси агентов, которые используются для защиты композиции от антимикробной активности (например, дрожжей, плесени, бактерий). Консерванты включают, помимо прочего, бензоат натрия, бензойную кислоту, этилендиаминтетрауксусную кислоту, сорбиновую кислоту, хлорид бензетония, хлорид бензалкония, бронопол, бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, тиомерозол, пропионат натрия, хлоргексидин, хлорбутанол, хлоркрезол. , крезол, имимочевина, фенол, соли фенилртути, сорбат калия, пропиленгликоль и их смеси. Предпочтительным консервантом по настоящему изобретению является бензоат натрия.
Все эти наполнители можно использовать в количествах, хорошо известных специалистам в данной области. Композиции пероральной суспензии могут быть приготовлены способами, хорошо известными специалистам в данной области.
Применение изобретения можно увидеть по следующим, не ограничивающие примеры:
Пример 1
Краткое описание производственного процесса:
Просеять цефиксим и сахарозу отдельно через подходящее сито. Также просейте другие вспомогательные вещества, такие как ксантановая камедь, коллоидный диоксид кремния, бензоат натрия и клубничный ароматизатор. Цефиксим и вышеуказанные эксципиенты измельчают примерно с 20% общего количества сахарозы.
Также просейте другие вспомогательные вещества, такие как ксантановая камедь, коллоидный диоксид кремния, бензоат натрия и клубничный ароматизатор. Цефиксим и вышеуказанные эксципиенты измельчают примерно с 20% общего количества сахарозы.
Все вспомогательные вещества вместе с лекарственным средством загружаются в блендер и смешиваются в течение заданного периода времени.
Исследование биоэквивалентности
Исследование биоэквивалентности проводили с использованием суспензии (испытания), содержащей цефиксим 200 мг/5 мл, приготовленной в примере 1, по сравнению с имеющейся в продаже суспензией для перорального применения «SUPRAX®» (цефиксим, эталон) с использованием двадцати пяти здоровых человеческие добровольцы.
10 мл эталонного продукта вводили с 5 мл тестируемого продукта.
Данные биоэквивалентности для этого исследования показаны ниже в Таблице 1. Исследование проводилось с точки зрения AUC и C max , достигнутых с тестируемым продуктом и эталонным продуктом. AUC представляют собой графики концентраций цефиксима в сыворотке по оси ординат (ось Y) в зависимости от времени по оси абсцисс (ось X). Как правило, значения AUC представляют собой ряд значений, взятых у всех субъектов в популяции, и, следовательно, являются средними значениями, усредненными по всей популяции. Cmax, наблюдаемый максимум на графике концентрации цефиксима в сыворотке (ось Y) в зависимости от времени (ось X), также является средним значением. Отношения логарифмически преобразованных средних значений для C max и AUC для тестируемого и эталонного продукта (отношение T/R) являются мерой биоэквивалентности между тестируемым и эталонным продуктом. Значения между 80 и 125% для 90%
AUC представляют собой графики концентраций цефиксима в сыворотке по оси ординат (ось Y) в зависимости от времени по оси абсцисс (ось X). Как правило, значения AUC представляют собой ряд значений, взятых у всех субъектов в популяции, и, следовательно, являются средними значениями, усредненными по всей популяции. Cmax, наблюдаемый максимум на графике концентрации цефиксима в сыворотке (ось Y) в зависимости от времени (ось X), также является средним значением. Отношения логарифмически преобразованных средних значений для C max и AUC для тестируемого и эталонного продукта (отношение T/R) являются мерой биоэквивалентности между тестируемым и эталонным продуктом. Значения между 80 и 125% для 90%
доверительных интервалов этих соотношений указывают на биоэквивалентность в соответствии с рекомендациями USFDA.


 INN
зарегистрированное ВОЗ
INN
зарегистрированное ВОЗ
 8 ч при приеме препарата вместе с пищей. Связывание с белками плазмы, главным образом с альбуминами, составляет 65%. Около 50% дозы выводится с мочой в неизмененном виде в течение 24 ч, около 10% дозы выводится с желчью. Т1/2 зависит от дозы и составляет 3-4 ч. У пациентов с нарушениями функции почек при КК от 20 до 40 мл/мин Т1/2 увеличивается до 6.4 ч, при КК 5-10 мл/мин – до 11.5 ч.
8 ч при приеме препарата вместе с пищей. Связывание с белками плазмы, главным образом с альбуминами, составляет 65%. Около 50% дозы выводится с мочой в неизмененном виде в течение 24 ч, около 10% дозы выводится с желчью. Т1/2 зависит от дозы и составляет 3-4 ч. У пациентов с нарушениями функции почек при КК от 20 до 40 мл/мин Т1/2 увеличивается до 6.4 ч, при КК 5-10 мл/мин – до 11.5 ч. 2
2 1
1



 )
) 595.32-112.34auc 0-T 106,296,79-116,56ок 0-дюймовых 105,796.79616.566auc 0-INF 105.796.79616.566AUC 0-INF 105.796.79616.566AUC 0-IN Результаты этого исследования позволяют сделать вывод, что суспензия цефиксима 200 мг/5 мл проявляет биоэквивалентность имеющейся в продаже суспензии «SUPRAX®» (цефиксим) 2×100 мг/5 мл.
595.32-112.34auc 0-T 106,296,79-116,56ок 0-дюймовых 105,796.79616.566auc 0-INF 105.796.79616.566AUC 0-INF 105.796.79616.566AUC 0-IN Результаты этого исследования позволяют сделать вывод, что суспензия цефиксима 200 мг/5 мл проявляет биоэквивалентность имеющейся в продаже суспензии «SUPRAX®» (цефиксим) 2×100 мг/5 мл.